
第十届全国抗肿瘤GCP培训班圆满结束
发表时间:2017-11-30 发表作者:liaoxingxing 文章来源:Admin5 浏览次数:147
- 第十届全国抗肿瘤GCP培训班圆满结束

第十届全国抗肿瘤GCP培训班(以下简称培训班)于6月25、26日在中国医学科学院肿瘤医院顺利召开。培训班是由中国医学科学院肿瘤医院举办,由优效(北京)医学研究有限公司协办。参加培训班的有来自医院、药企、CRO、SMO等机构的593人,其中医学科学院肿瘤医院298人。
此次培训班邀请到我国具有丰富GCP经验的医学专家。专家学者们分享了关于抗肿瘤药物临床研究最新进展,对722药监局现场核查临床试验的主要问题进行了深度的分析,也更加明确强调质量控制和伦理等问题在临床研究中重要性,并且展望了高新技术在今后临床研究中的应用。此次培训班由中国医学科学院肿瘤医院GCP中心办公室主任李树婷主持,肿瘤医院石远凯副院长和教育处周彩虹处长在开幕式上致辞。
 石远凯院长
石远凯院长  周彩虹处长
周彩虹处长此次培训班邀请到的主要讲着有: 孙燕,1956年毕业于协和医科大学获临床博士学位,1959年起在中国医学科学院肿瘤医院工作至今。现任中国医学科学院肿瘤医院国家新药(抗肿瘤)临床研究主任,协和医学院临床肿瘤学教授。孙燕教授带我们回顾了中国医学科学院肿瘤医院从1995年第一届GCP培训班开始至今这21年的发展以及对未来抗肿瘤药临床研究的展望。
 孙燕教授
孙燕教授中国医学科学院肿瘤医院副院长石远凯先生,石远凯先生是肿瘤学博士,研究生导师,肿瘤内科主任医师,国家癌症中心副主任。石院长与我们分享了中国抗肿瘤药的研发历史,也让我们学习到了我国抗肿瘤药临床研究的最新进展,并强调了质量管理是临床试验中的生命线,为本次培训奠定了一个扎实的基础。
 石远凯院长
石远凯院长 徐明利,北京豪迈东方医药科技发展公司总经理,专门从事肿瘤领域的新药临床研究工作15年,并于2012年开始作为独立第三方,为中国医学科学院肿瘤医院开展所有临床试验项目稽查。徐经理就药监局7-22现场核查临床试验出现的问题(如:试验数据的真实性、AE/SAE漏报、 原始数据不能溯源、方案违背、ICF问题、数据统计问题等),针对性的做出了分析讲解。
 徐明利总经理
徐明利总经理 李树婷主任从1996年开始从事抗肿瘤药临床研究(GCP)和伦理委员工作,是我国最早实施GCP的人员之一。李树婷主任的授课分为两场。第一场李树婷主任根据国家食品药品监督管理局7-22现场核查中的重点内容(数据的真实性、完整性、规范性),给学员们逐一详细地分析讲解。首先是数据的真实性问题,存在真实性问题的根源是:1,数据不能溯源;2,AE漏记,SAE漏报或瞒报;3,实验室检查结果不能溯源;4,用药记录/病例记录缺失或铅笔修改;5,受试者日志无签字或由研究者签字等等。其次是完整性:临床试验数据的不完整/不一致,主要体现在临床诊疗数据与临床试验数据不一致/不完整。这两个问题体现出临床试验的不规范性问题。李树婷主任提出,能够满足新标准,解决目前临床研究出现的问题主要可以通过以下几点:1.通过培训提高GCP意识、2.实事求是,如实记录和填写,按规范修改、3.不补数据,不因为隐瞒一个错误说更多的谎言4.严格执行方案,不自作主张。李树婷主任的第一场授课提到了目前临床研究存在的诸多问题,第二场则阐述了现阶段抗肿瘤药临床试验的特点以及难点。第一点就是抗肿瘤试验时间长;第二点是入排标准复杂;第三点是研究的流程复杂;第四是临床试验设计种类和变化多;第五点是临床试验疗效评价复杂;第六是临床试验风险高等等。这么多的难题,遇上诸多的问题,唯一的解决就是严格的质量控制。李树婷主任强调:无论是临床研究的哪个环节,从受试者入组开始,到试验结束,都要做到严格把控质量。这就是提高临床研究成功率的唯一保障。{dede:pagebreak/}

 李树婷主任
李树婷主任 马建辉,1983年毕业于白求恩医科大学,中国医科学院肿瘤医院医务处处长。马建辉处长和大家分享了在临床研究试验设计时的伦理问题。马建辉处长认为试验设计时三大要素(研究对象、处理因素、试验效应)和三大原则(对照原则、随机化原则、重复原则),让临床研究试验设计时就必须要考虑到试验要有充分的科学依据,要有明确的入、排标准,研究者必须是相关的专业人员,知情同意应该简单、易懂,而且不能夸大收益,诱导或胁迫受试者。并列举了过往临床试验设计存在的一些违背伦理的实例。
参加此次培训班的讲着还有:中国医学科学院肿瘤医院内科主任医生王洁教授,王教授为我们带来了肿瘤靶向治疗时代液体活检在临床中的应用以及未来的发展趋势;
 王洁教授
王洁教授复旦大学生物医学研究院PI、博士生导师刘雷,刘雷先生在医学大数据方面有着卓越的成就。刘雷阐述了大数据在临床研究中有着越来越重要的地位;
 刘雷
刘雷医学科学院肿瘤医院博士杨晟,杨博士与大家分享了肿瘤免疫治疗的最新研究动态
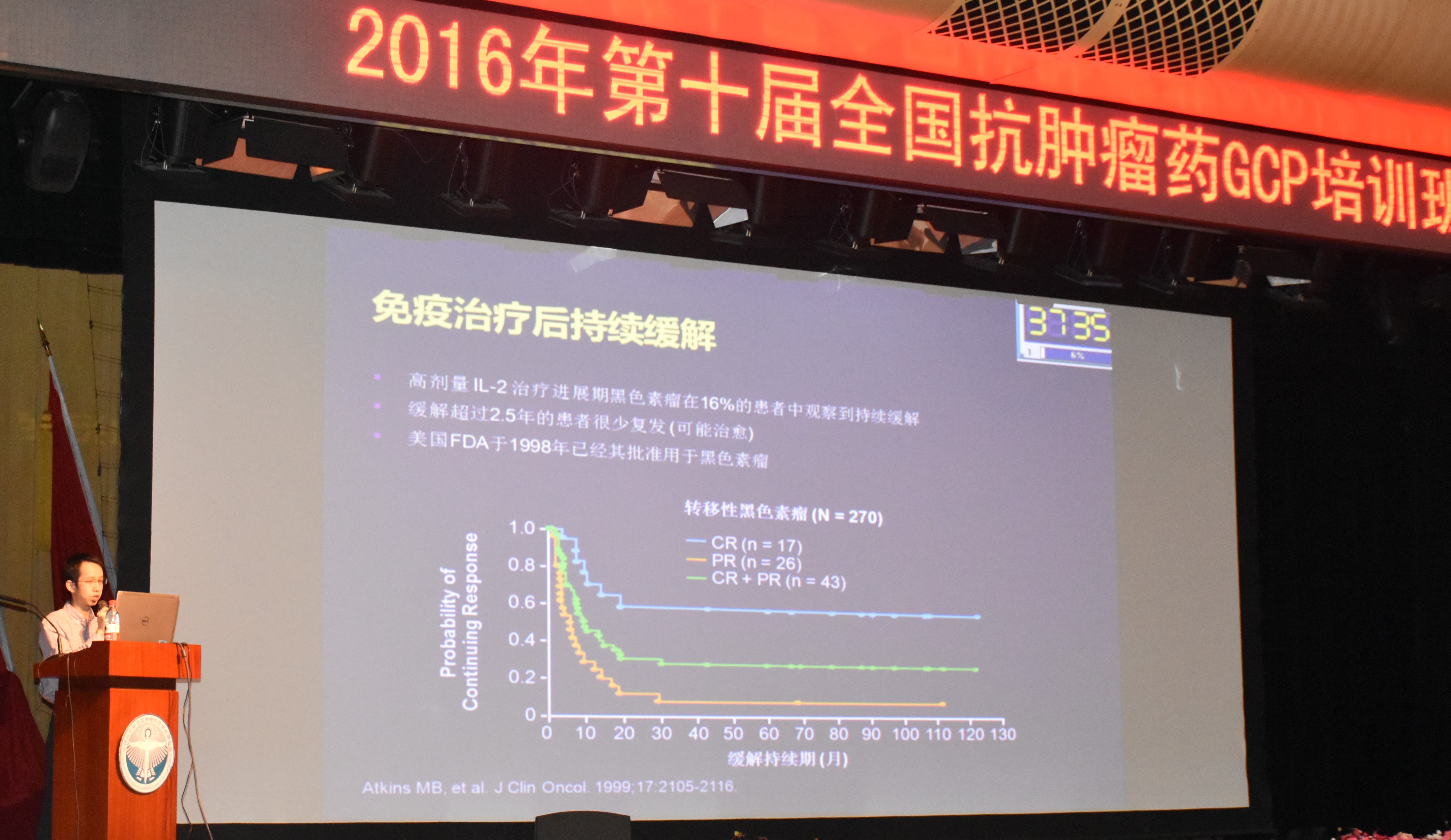 杨晟博士
杨晟博士徐兵河教授用漫画的方式生动的讲解了肿瘤免疫治疗药物的不良反应以及各种不良反应发生后的处理方式。
 徐兵河教授
徐兵河教授全球医生组织中国总代表时占祥先生,前瞻性的考量了智能机器人在临床研究中能够起到的作用,可以给临床研究减少足够的时间成本和人力成本;
 时占祥先生
时占祥先生 嘉兴太美医疗科技有限公司药物警戒总监万帮喜,万先生给我们带来了一个全新的词汇:药物警戒(与发现、评价、理解、和预防不良反应或其他任何可能与药物有关问题的科学研究与活动)。万帮喜先生提倡关注药物安全,建议药物上市后再研究药物的疗效和安全性。
 万帮喜总监
万帮喜总监 培训班期间,每个休息的间隙都设计了提问与解答环节,专家们就学员提出的有关试验设计,
方案违背后的处理方法等问题一一进行了详细的解答,学员们都纷纷表示接受完此次的培训受益匪浅。最后,培训班就所有听课学员进行了严格测试,对测试合格的学员颁发了GCP证书。




 提问与解答环节
提问与解答环节至此,历时两天的第十届全国抗肿瘤GCP培训班就圆满的结束了,让我们期待下一期培训班的召开。
